Termodinamika a folyamat - studopediya
Termodinamikai folyamatok ideális gázok
Termodinamika vizsgálja öt fő folyamatok ideális gázok:
1. Helmholtz. (V = const) előforduló állandó térfogatú gáz;
2. Gibbs, (p = const) előforduló állandó nyomáson;
3. izoterm (T = const) származó konstans tempera-kerek;
4. adiabatikus. (Q = 0) áramló nélkül ellátó vagy eltávolítására hőt, azaz, zavartalanul hőcsere a környezetre;
5. politrop - szintézise folyamat változó paramétereit a munkaközeg hőcserélő; az ő előző négy eljárás speciális esetei.
Izochor vagy izochor folyamat (az ókori görög. # 943; # 963; # 959; # 962; - „egyenlő”, és # 967; # 974; # 961; # 959; # 962; - „hely, lakótérbe”) - egy termodinamikai folyamat, amely állandó térfogaton. Megvalósítása izochor állapotváltozás egy gáz vagy folyadék ahhoz, hogy hő (hideg) egy anyagnak a hajó, amely nem változtatja meg a izochor állapotváltozás oboma.Pri ideális gáz nyomása egyenesen arányos annak hőmérsékletét. A valós gáztörvény Charles nem kerül végrehajtásra.
A grafikonok ábrázolt vonalak, amelyek úgynevezett isochors. Egy ideális gáz, ezek egyenes minden diagramok, amelyek kötődnek paraméterek: T (hőmérséklet), v (térfogat), és a P (nyomás).
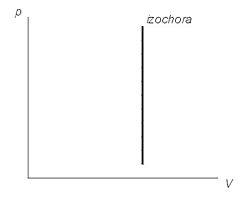
Graph izochor folyamatábra (P, V)
A meghatározás a munka, hogy a változás működésre izochor folyamat:
Annak megállapításához, a teljesítményét a folyamat, mi integrálja ezt a kifejezést. Mivel a kötet változatlan, akkor:
Azonban az ilyen szerves nulla. Tehát amikor izochor folyamat gáz nem működik:
Grafikailag sokkal könnyebb bizonyítani. Egy matematikai szempontból, a folyamat a munka - az a terület, a diagram alatt. De a menetrend izochor állapotváltozás merőleges az x-tengelyen. Így az alatti terület ez nulyu.Izmenenie belső energiája egy ideális gáz megtalálható a következő képlet:
ahol i - a száma szabadsági fokok, ami függ a atomok száma a molekulában (az egyatomos 3 (például, neon), 5 kétatomos (például oxigén) és 6. háromatomos vagy több (például, egy molekula vízgőz)).
A definíció és fajhője általános képletű és általános képletű energia belső átírható, mint:
ahol - a moláris hőkapacitás állandó térfogaton.
A termodinamika első főtétele megtalálható, amikor a hőmennyiség izochor folyamat:
De izochor folyamat gáz nem csinál a munkát. Azaz, a következő egyenlet érvényes:
azaz a hőt, amely megkapja a gáz megy a változás belső energia.