Móltömeg oxigén (O), és példák a általános képletű
Moláris 1 mól egy adott anyag, grammban kifejezve, az úgynevezett moláris (mol) súlyú.
A mértékegység a moláris tömeg g / mol vagy kg / kmol. Moláris anyag tömege grammban számszerűen azonos molekulatömegével (atomi) tömege kifejezve atomtömeg egység:
A relatív atomtömeg egyenlő a atomos oxigén 15,99903 amu A relatív molekulatömege egyenlő 15,99903, és a móltömeg:
M (O) = úr (O) × 1 mol = 15,99903 g / mol.
Köztudott, hogy a kétatomos oxigén molekula - O2. Ezután a relatív atomtömeg oxigénmolekulák lesz egyenlő:
Ar (O2) = 15,99903 × 2 = 31,99806a.e.m.
A relatív molekulatömege egy molekula oxigén egyenlő 31,99806, és a móltömeg:
M (O2) = úr (O2) × 1 mol = 31,99806 g / mol, vagy csak 32 g / mol.
Oxigén gáz színtelen és szagtalan (atomi szerkezetének ábrán látható diagram. 1.), gyengén oldódik vízben nagyon alacsony olvadási hőmérséklet (-218,9 ° C), és forráspontja (-183 ° C).
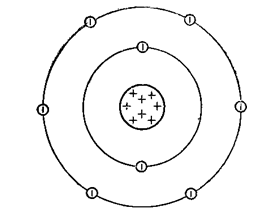
Ábra. 1. Szerkezet egy oxigénatom.
A moláris tömege a gáz lehet kiszámítani a termék a maga sűrűsége viszonyítva bármely más gáz által a molekulatömeg az utóbbi. Alatt sűrűség aránya a tömeg egy bizonyos mennyiségű gáz tömege azonos térfogatú másik gázzal (azonos hőmérsékleten és nyomáson), a molekulatömege amely ismert.
A molekulatömeg az anyag gáz halmazállapotban is számítható ismerve annak moláris térfogata: megtalálják a mennyiség (STP) által elfoglalt fajlagos tömege az anyag, majd kiszámítja a tömege 22,4 liter ez az anyag azonos körülmények között.
Emellett ezek a módszerek annak meghatározására, moláris tömege a gáz, akkor lehetséges, hogy a ideális gáztörvény (Mengyelejev-Clapeyron egyenlet), de ez a módszer a legkevésbé pontos az összes fent.
Példák problémák megoldása
Tömegének kiszámításához oxigén előállítható a bomlás higany-oxid (II) tömegű 65,1 g