Hogyan számoljuk ki a atomtömeg
Atomsúlya összege a tömegek a protonok, neutronok és elektronok, amely egy adott atom vagy molekula. [1] összehasonlítva protonok és a neutronok, elektronok tömege nagyon kicsi, ezért nem tekinthető a számításokban. [2] Bár rendesen a formális szempontból, ezt a kifejezést gyakran használják utal az átlagos atomtömege összes izotópok egy elem. Valójában, ez a relatív atomtömeg, más néven atomsúlya egy elem. [3] atomsúly - az átlagos atomtömege összes izotópok egy elem természetben előforduló. Vegyészek megkülönböztetni a két típusú atomtömegű végzésekor munkáját - a hibás érték atomtömegű lehet, például vezethet helytelen eredmény a reakció hozamát.
lépések szerkesztése
1. módszer 3:
Megkeresése atomtömeg az elemek periódusos szerkesztése


- A atomi tömegegység jellemzi a tömege egy mól az elem grammban. Ez az érték nagyon hasznos a gyakorlati számításokban, mivel segíthet, hogy könnyen át egy előre meghatározott mennyiségű tömegű atomok vagy molekulák az anyag mol, és fordítva.


- Figyeljük meg, hogy minden relatív atomi tömegek szerepel a periódusos rendszer, az egyes tételek átlagértékek. A kémiai elemek eltérő izotópokat - kémiai variánsok különböző tömegek miatt a kiegészítő vagy hiányzó neutronok az atommag. [5] Ezért, a relatív atomi tömegeket felsorolt a periódusos lehet használni, mint az átlagos értéket a atomok egy adott elem, de nem a tömeg egy atom az elem.
- A relatív atomtömeg tartalmazott a periódusos, kiszámításához használt moláris tömegeket az atomok és molekulák. Atomic tömeges kifejezve amu (Amint a periódusos) lényegében dimenzió. Azonban, egyszerűen megszorozva az atomsúlya 1 g / mol, megkapjuk hasznos jellegzetes eleme - tömege (grammban) per mól atomok ezen elem.


- Mivel az átlagos atomsúlya egy átlagos érték több izotópok, a megadott értéket a periódusos nem a pontos értékét a bármely különálló atomtömegű atom.
- A atomtömeg az egyes atomok, hogy figyelembe véve számítják ki a pontos számát a protonok és a neutronok egy egyetlen atom.
2. módszer 3:
Kiszámítása atomtömege egyetlen atom szerkesztése
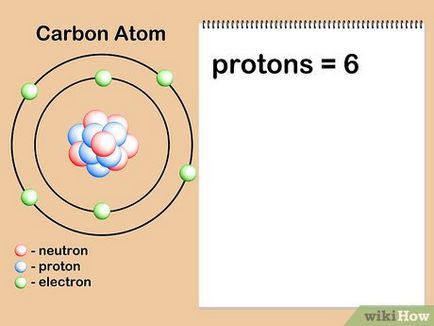

- Tegyük fel, hogy mi érdekli szénatom. A szénatomok mindig hat protonok, így tudjuk, hogy atomi szám 6. Ezen kívül, azt látjuk, hogy ott az a szám „6” a periódusos, a felső része a sejt szén (C), jelezve, hogy az atomi a szénatomok száma egyenlő hat.
- Megjegyezzük, hogy a atomszáma az elem nem kapcsolódik egyedileg a relatív atomtömeg a periódusos rendszerben. Bár, különösen a tételek a táblázat tetején, úgy tűnhet, hogy a atomtömeg az elem kétszer atomi száma, akkor soha nem kell kiszámítani, hogy a atomi száma kettővel.
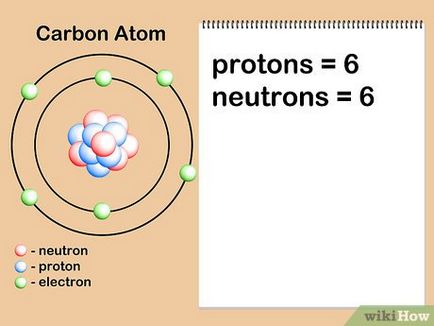

- A neutronok száma lehet meghatározni jelölés elem izotópja. Például, a szén-14 jelentése radioaktív szén-12, a természetben található. Gyakran izotóp száma van feltüntetve, mint felső index számok, előtt áll a szimbólum elem 14 C. A mennyiségét neutronok kivonásával kapott protonok száma az izotóp szobában: 14-6 = 8 neutronok.
- Tegyük fel, hogy mi érdekli-szénatom hat neutronok (12 C). Ez a leggyakoribb izotóp a szén, körülbelül 99% az összes atomok egy adott elem. [7] azonban körülbelül 1% a szénatomok a 7 neutronok (13 C). Más fajta szénatomok 7-nél nagyobb, vagy kisebb, mint 6 neutronok és léteznek nagyon kis mennyiségben.
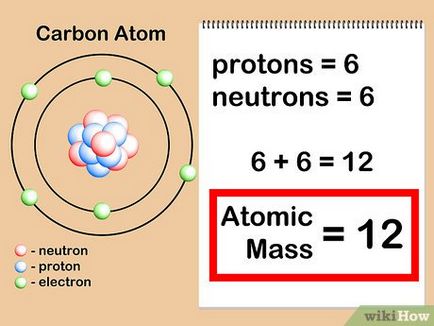

- A szénatom 6 protonok + 6 neutronok = 12. Tehát a atomsúlya a szén egyenlő 12. Ha ez volt az izotóp „szén-13”, akkor azt tudja, hogy ő 6 protonok + 7 = neutron nukleáris tömege 13.
- Tény, hogy a atomtömege szén-13 13,003355 [8]. és ez az érték pontosabb, mert úgy határoztuk meg a kísérletezést.
- Atomtömeg nagyon közel van a száma az izotóp. A könnyebb kiszámításához az izotóp szám gyakran egyenlővé tesszük a atomtömeg. A kísérletileg meghatározott értéke atomtömeg az izotóp kismértékben meghaladja a száma csak kis mértékben járult az elektronok.
Hogyan állapítható meg, az oxidáció mértékét


Hogyan lehet megtalálni a protonok száma, neutronok és elektronok

Hogyan számoljuk ki a koncentrációja az oldatban

Hogyan készítsünk szárazjég


Hogyan kell használni a periódusos rendszer


Hogyan tároljuk száraz jég

Hogyan savanyítja a talajt


Hogyan számoljuk ki a molaritásának a megoldás


Semlegesítése ammóniával


Hogyan át a vizsgán a kémia