Gázkeverék és annak összetétele
Minták korábban tárgyalt adott gázok, amelyek tiszta anyagok, azaz a amelyben az összes molekulák azonos.
Az alkalmazott technika nem csak tiszta gázok, hanem keveréke tiszta gázok (például levegő, amely nitrogén- és oxigén, nitrogén-hidrogén keverékben, stb).
Gáz smes- mechanikus gázok keveréke, amelyek mindegyike törvényei alá tartoznak ideális gázok.
Az elegyet reagálnak kémiailag. Megtartják kémiai azonosság. Gáz keverékek, például atmoszferikus levegőt vagy égéstermékek az égési készülék és gőzkazánok, belső égésű motorok és a gázturbinák. Ezek a keverékek olyan különösen a nitrogén, szén-dioxid, kén-dioxid, a vízgőz és az oxigén.
Egy konkrét esetben a gázkeverékek a keveréket ideális gázok. Ismerete viselkedése ideális gázkeverék lehetővé teszi, hogy a viselkedését keverékéből reális gázok.
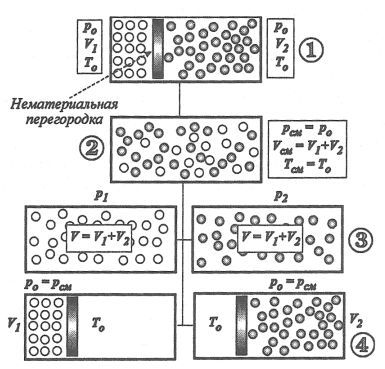
Ábra. 1.1.11 meghatározása adott (részleges) nyomás és a térfogat a gázkeverék komponenseket
Engedje meg, hogy az úgynevezett részleges (redukált) komponens mennyisége. Töltsük a henger két különböző gázok, elválasztva őket teljesen rendben (nem anyagi) fala (ábra. 1.1.11).
Az intézkedés alapján gáznyomás a bal és jobb oldali kialakítottak bármilyen köztes helyzetben, amelyben a gáznyomás rá, a jobb és bal - egyaránt. Legyen a két gáz azonos hőmérsékleten T0 (1 állapot; ris.1.1.11). Mind a gáz egyenlő nyomás és hőmérséklet térfogatot foglal el a V1 és V2.
Távolítsuk el toll városban. A gázok keverednek (2. feltétel). A nyomás és a hőmérséklet a gázelegy nem változik, vagyis a. E.
Mind a gáz, hogy az állami elfoglalja a teljes térfogat, vagyis az egyik, hogy elfoglalt, mielőtt összekeverjük a VCM = V 1 + V 2.
Most fog fordulni, hogy távolítsa el a henger a két gáz. A tartály marad más gázt, amely elfoglalja a teljes térfogat V = VCM (állami 3).
Minden ilyen esetben a gáz nyomása a hengerben esik P0 = Rcm a P1 vagy P2 (mindkettő által korábban elfoglalt gáz teljes hosszában a tartály térfogata, és most elfoglalja az azonos mennyiségű minden gáz külön-külön). Mentése bármely lehetséges módjait az egyes gáz hőmérséklete a hengerben, a hőmérséklet egyenlő ezek keverékei SCI. Így, egyes gázok külön hőmérsékleten T1 = T2 = SCI és a képernyő VCM = V 1 + V 2 hoz létre nyomást a P1 vagy P2
A nyomás, ami hozna létre mind a gázkeverék egyénileg (más gázokat eltávolítjuk) azonos térfogatú, mint mielőtt az egész keveréket tartott, és feltéve, hogy a hőmérséklet megegyezik a keverék hőmérséklete, T1 = T2 = SCI. nazyvaetsyapartsialnym (csökkentett) nyomáson.
Az alaptörvény a viselkedése az ideális gázkeverék Dalton-törvény. azt állítva, hogy minden egyes gáz a keveréket úgy viselkedik, mintha hőmérséklete a keverék, sem veszi az egész keverék térfogatát.
Mind a gázok a keverék kialakítására van egy nyomástartó edény falán úgynevezett parciális nyomása. Megszálló térfogata azonos térfogatú keveréke egyes gázok a keveréket alkotó alatt annak parciális nyomása és az elegy hőmérsékletét.
Nyomás gázkeverék összegével egyenlő Dalton törvénye parciális nyomása:
Mennyiségek meghatározásánál milyen jellemző gázkeverék, meg kell tudni, hogy a gáz összetételét. Ez határozza meg az összeget az egyes gázok a keverékben, és be van állítva a tömege vagy térfogata.
Ahhoz, hogy adja meg a keverék összetételének, a tömege és térfogata frakciók:
Tömeghányadát belépő gáz a keverék aránya a tömegét a teljes keverék tömegét.
A tömegarányai a komponensek a gázkeverék meghatározzuk:
Molekulák az egyes gázok belépő az elegyet egyenletesen oszlik el a térfogatot, úgy, hogy minden a gázok alkotó az elegyet egyenletesen oszlik el a teljes mennyiséget, és elfoglalja az azonos térfogatú, mint az egész keveréket.
Annak megállapítására, térfogathányada egy komponens bevezeti a részleges térfogat komponens.
Most, hogy a gázok folytassa másként. Mind a gázkeverék csökkenteni fogják a partíció egyedileg, mielőtt a nyomás jön létre ezeknek a keveréke gázok a teljes képernyőn henger, azaz abban az állapotban 2. Amikor sűrített gáz hőmérséklete emelkedik, és ezért a henger lesz lehűtjük, ezáltal az állandóság minden gáz hőmérsékletét . Fontos, hogy a gáz összenyomódik, a hőmérséklete maradt hőmérsékleten a gáz elegy, vagyis T = T1 = T2 = SCI (állami 4).
Így minden gáz egyenként nyomás és a hőmérséklet megegyezik a nyomás és hőmérséklet, a gázkeverék a P = P1 = P2 = PCM. T = T1 = T2 = SCI. elfoglal egy bizonyos mennyiség (V1, illetve, vagy V 2).
Ez az úgynevezett részleges térfogat (csökkenti).
Obomomkomponenta úgynevezett részleges térfogat amelyben az lenne, elfoglalják a hőmérsékleten és nyomáson a keverék.
Nyilvánvaló, hogy ebben a példában, a részleges (redukált) mennyiségű gáz térfogata összekeverés előtt V 1 és V 2.
Ha a gázkeverék áll n gázok el van látva az
lévő komponensek mennyisége a keverék keresztül V 1. V 2, .... Vn, és a keverék térfogatát keresztül V cm. Ezután
térfogathányada egyes eleme a gázkeverék az aránya részleges térfogat térfogatának a teljes keverék.