Az elektronikus konfigurációja atomok
Az elektronok a sejtmagban nem elrendezve véletlenszerűen, és a rétegek - energiaszintet. Ezek a szintek emeleten az épület - az első, második, harmadik és így tovább.
És még az egyes szinten vannak az elektronikus sublevels - s, p, d, f, amelyek úgy vannak elrendezve rendre atomi pályák s, p, D, F-típusú.
Minél nagyobb a szám „padlón” - szinten, a „fent” (távolabb a nucleus) elektronokat ezt a szintet.
Az első szinten lehet egyetlen s-szintalatti,
a második két sublevels: s és p.
- a harmadik „három sublevels (s, p és d), a negyedik - négy (s, p, D, F).
Elektronikus alszintjük, valamint az energia- és a padló - szintje változik a hatalom.
Ezek található különböző energia „magas”.
A tudósok egyetértenek abban, hogy jelölésére egyes atomi
kvantum sejt - tér az energia diagram:
On -podurovne s lehet az egyik atomi, és p -podurovne lehet három (a három tengely):
Pályák a d - és f -podurovnya egy atom lehet öt és hét, rendre:
Minden elektron fogja jelölni egy nyíl mutat felfelé vagy lefelé, és ugyanabban az időben csak egyetértenek abban, hogy a kvantum doboz lehet helyezni legfeljebb két elektron nyilak különböző irányba mutató, valahogy így:
teljesen betöltötték elektronokkal
Minden elektronikus szintek és sublevels, hogy még csak most festenek, mint a diagramok, jellemzi egy bizonyos energia.
És ami a legfontosabb, minden az elektronok egy atom, ez a „bizonyos energia” van egy negatív értéket (kevesebb, mint 0), és ez még inkább negatív, mint az orbitális közelebb a sejtmagba.
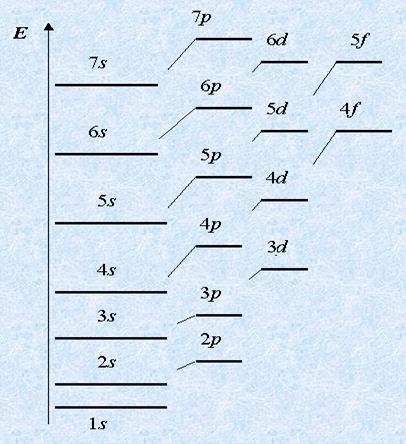
Az első tele van a legjövedelmezőbb első energiaszintje, és csak ezután a második, harmadik, és így tovább. Sőt, az azonos szinten először töltjük alréteg amelynek energiája alacsonyabb. Például, az első két elektron esik a 2s-alréteget, majd - 2p szintalatti; első 3s, majd 3p szintalatti.
De akkor a zavart kezdődik: miután 4s be van töltve a 4p, és a 3D-szintalatti. De ez csak első pillantásra. Tény, hogy minden a szabályok szerint, mert az energia a 3d-szintalatti alacsonyabb 4p. Ezért ő foglalkozott elektronok előtt.
Mozgó atomi pályák az elektronok. Általában minimum energia, a Pauli-elv és Hund szabály
Ülepítő atomi pályák az elektronok szabály határozza meg a minimális energia Pauli-elv és a Hund-szabály.
Az elektronok foglalnak atomi pályák, hiszen alréteg alacsonyabb energia. Ez általában egy minimális energiát. Összhang az energia felhalmozódását Melyek sublevels: 1s <2s <2p <3s <3p <4s ≤ 3d <4p <5s и так далее …
A számítások szerint az elektron mozog nem adott utat, és lehet bármely részén, a mag körüli tér - azaz csak akkor tudjuk beszélni a valószínűsége (lehetőség) a helyszín egy bizonyos távolságra a sejtmagban.
Az elektronok az atomokban elfoglalják a energetikailag kedvező atomi pályák (orbitáijaihoz legalacsonyabb energia), hogy létrehozzák a elektron felhők egy bizonyos alakja.
Abban az esetben, s-orbitális elektron felhő gömb alakú:
Abban az esetben, p-pályák alkotják az elektron felhő súlyzó :.
Belül az atomi pályák a valószínűsége, hogy az elektron nagy; Más szóval, van egy nagy elektronsűrűség. A tér hatályán kívül a pályák megfelel egy alacsony elektronsűrűség.
Minden atomi pályák lehet helyezni legfeljebb két elektron (Pauli-elv).
A jelenlétében a pályák az azonos energiával (például, a három p pályák egy szintalatti) egyes orbitális van töltve első felében (és ezért a p-al-réteg nem lehet több, mint három párosítatlan elektront), majd teljesen alkotnak elektron párokat (Hund szabály) .
A számos lehetséges sublevels azonos szintű számot. Az első szinten található egy
s-szintalatti. A második réteg két alrétegből - s és p. Harmadik szint - három sublevels - s, p és d.
Minden alrétegében szigorúan korlátozza az elektronok száma:
az s-szintalatti - nem 2e
A p-szintalatti - nem 6e;
A d-szintalatti - nem több, mint 10 mp.
az egyik szint alatti szint van töltve szigorú sorrendben: s p d.
Így p-sublevels nem tudja elkezdeni kitölteni, ha nem töltött s-airétegeinek az energia szint, stb
Az energia diagramja elektronhéjak atomok hidrogén és hélium:
hidrogénatom elvesztheti a egyetlen elektron, amely szintén a külső, és a vegyérték és lesüllyed egy hidrogén-kation:
H: 0 - 1 e- = H +
Ez azt jelenti, hogy a hidrogén oxidálódik - részt vesz az oxidációs folyamat. De hidrogénatom lehet visszaállítani, és - hogy elfogadja elektron. A helyreállítási folyamat hidrogén anion, amely más néven egy hidrid anion:
H 0 1 + e- = H -
A szénatom vált nemcsak képesek feladni a elektronok - oxidált, hanem, hogy - vissza:
C 0-4 e- = C + IV
C 0 + 4 e- = C -IV
Valódi kationok és anionok szén léteznek, ezért a fenti egyenletek a reakciók itt írásbeli karakter szénatomos oxidációs állapota + IV és -IV.
Az oxidációs állapot - ez kondicionált töltés, amely lehet az atomok különböző elemek kémiai vegyületek.
Egyes minták a periódusos rendszer D. Mengyelejev.
A periódusos rendszer elrendezi nemcsak az elemek, hanem a legkülönbözőbb tulajdonságokat. Vegyész gyakran elég ahhoz, hogy a szemem előtt a periódusos rendszer, annak érdekében, hogy helyesen válaszolni egy csomó kérdést (nem csak a vizsga, hanem a tudományos).
Nézzük újra a periódusos rendszer. Amellett, hogy a mély alapvető kapcsolat az elemek között, tükrözi számos hasznos a tanulmány a kémiai törvényekkel. Tekintsük a legfontosabb ezek közül (ábra.).
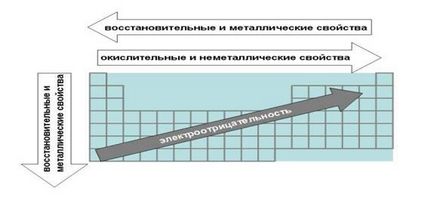
Ábra. Törvények a periódusos rendszer, társított elektronegatív fém és redox tulajdonságai elemek.
a) törvények kapcsolódó fémes és nem fémes elemek tulajdonságai.
1. Amikor a mozgó jobbról balra mentén időszakban fémes elemtulajdonságok fokozott. Az ellenkező irányban növeli a nemfémes.
Ez annak a ténynek köszönhető, hogy a szabályok az elemek, amelyek az elektron pályák közelebb az oktett. Elemek a jobb oldali részén az időszak kevésbé valószínű, hogy adják fel a elektronok alkotnak egy fémes kötést, és általában a kémiai reakciókban.
Például, a szén - nemfémes kifejezettebb, mint a szomszédja a időszakban bór, és nitrogén egy élénkebb nemfémes tulajdonságokkal, mint a szén.
Balról jobbra egy olyan időszakban is növekedett, és a díjat a sejtmagban. Ezért egyre nagyobb a vonzereje, hogy a mag és vegyérték elektronok akadályozzák azok visszarúgás.

c) törvények méreteire vonatkozóan az atomok.
6. Méretek atomok (atomrádiusz) mozgatásakor balról jobbra mentén időszakban csökken. Ez annak tulajdonítható, hogy az a tény, hogy az elektronok egyre vonz a magban, a nukleáris díj emelkedik. Még növekedett az elektronok száma a külső héj (például fluor- képest oxigén) nem növeli a méretét egy atom. Éppen ellenkezőleg, a méretei fluoratom kisebb, mint az oxigénatom (ábra. 4).
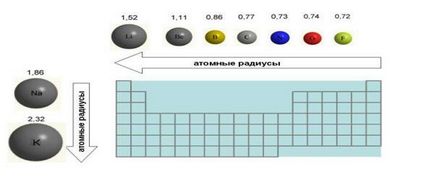
Ábra. Megváltoztatása atomrádiuszok a elem például a 2. időszak és az 1. csoport, a periódusos rendszer. Atomrádiuszok megadott Angström (1 A = 10 -8 cm).
7. Amikor az TOP-DOWN atomrádiuszok elemek egyre növekszik, mert tele van több elektronikus kagyló.
Periodicheskiyzakon Mengyelejev: tulajdonságai kémiai elemek, valamint tulajdonságait egyszerű és komplex vegyületek által alkotott közülük a rendszeres díjat függően atommagba.
A fizikai értelmében a periodikus törvény: tulajdonságai kémiai elemeket periodikusan ismételjük, mert ismételt periodikusan konfigurációmenedzsment vegyérték elektronok (elektron eloszlás és utolsó előtti külső szintek).