A kémiai reakció sebessége
A kémiai reakció sebességét. Definíció.
Kémiai reakciók folytassa különböző sebességgel. A jól ismert eddigi leggyorsabb reakció fordul elő 10-40-szer gyorsabb, mint a leglassabb. Az átalakulás a grafit a gyémánt a föld gyomrában - nagyon lassan reagál. A keveréket az oxigén hidrogén-robbanás történik gyakorlatilag pillanatszerűen.
Hogyan összehasonlítani az árak a reakciók mennyiségileg?
Speed - a változás bizonyos mennyiség idővel.
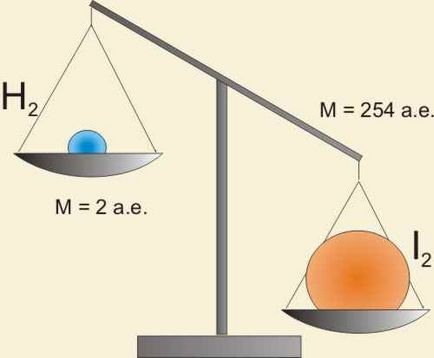
H2 + I2 = 2HI
Próbálja meghatározni a reakció sebességét kiadások reagensek egységnyi idő alatt. Például így:
v (H2) = m (H2) / D t, v (I2) = m (I2) / D t
ahol v - a reakciósebesség, m - tömeg alábbhagyott megfelelő reagenssel, D T - időintervallum.
De v (H2) nem egyenlő a v (I2). A tömegek a hidrogén és jód reagáltatjuk egységnyi idő nem egyenlő.
A reakciót moláris aránya 1: 1, de nem a tömeges! Próbáljuk másképp:
v (H2) = N (H2) / D t, v (I2) = N (I2) / D t
ahelyett, hogy a tömeges mennyiségű anyagok.
v (H2) = v (I2)
De ha az első esetben vesszük a mólszámainak csökkenés egységnyi idő alatt 1 ml keveréket, míg a második - 1 liter keverék, a sebesség egyenlő lesz újra! Függnek a hangerőt. Ha felhívni azonos reakciót egy kis kémcsőbe, és egy nagy hordó, az in vitro reagálnak kisebb számú anyagok - egyszerűen azért, mert kevesebb reagenst.
És ha az eredmény ezek a kifejezések az egységnyi térfogatú?
v (H2) = N (H2) / V D t = D c (H2) / D t, v (I2) = N (I2) / V D t = D c (I2) / D t
ahol D c változó a moláris koncentrációk a megfelelő anyagok vonatkozásában.
Ezután VH2 = VI2 = v ez a reakció!
Így a végső meghatározás lesz:
Az arány a kémiai reakció - a változás egyik moláris koncentrációjának a reagensek időegységenként: